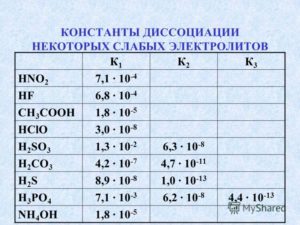
Константа диссоциации слабых электролитов.
(Здравствуйте уважаемый читатель.Наше настоятельное пожелание-посетите главную страницу сайта.)
Между степенью диссоциации и концентрацией электролита существует взаимосвязь,раскрытая В.Оствальдом в 1888 г.Он рассмотрел химическое равновесие между недиссоциированными молекулами и ионами.Например,
CH3COOH(водн)⇔H+ (водн)+CH3COO— (водн)

Для расчета степени диссоциации α слабой кислоты в простом случае
HA⇔H++A—
введем следующие обозначения:C-аналитическая концентрация слабой кислоты;[HA],[H+],[A]-равновесные концентрации соответствующих частиц.С учетом уравнения диссоциации,можно записать:
[H+]=[A—]= αC [HA]=(1- α)C
Константа равновесия,или константа кислотной диссоциации Ka
(a-от англ.acid-кислота),имеет вид:
Ka=[H+][A—]/[HA]
Следовательно,
Ka=α2C2/(1-α)
Т.к. для слабых электролитов α много меньше 1,то можно принять (1-α)≈1.
Отсюда
Константа равновесия,или константа кислотной диссоциации
Ka≈α2C и α≈(Ka/C)1/2
То есть степень диссоциации обратно пропорциональна квадратному корню из концентрации.Эта зависимость известна как закон разбавления Оствальда.
Для слабого основания выражение аналогично,константу диссоциации которого принято обозначать Kb(b-от англ.base-основание).