Энтропия что это такое простыми словами.
Простыми словами про энтропию можно сказать так:энтропия-это беспорядок,хаос.Но это очень грубо,просто неграмотно.Поэтому надо всё-таки надо поднапрячься и разобраться посеръёзней.
Обратимся ко второму началу термодинамики.Оно утверждает:
В изолированной системе самопроизвольно могут протекать только такие процессы,которые ведут к увеличению неупорядоченности системы,т.е.к росту энтропии.
И это подтверждает,что энтропия-хаос.Но есть нюансы.Совершенно строго энтропия была введена в термодинамике как функция состояния системы S,изменение которой определяется отношением количества теплоты Q,полученной (или отданной) системой при температуре T, к этой температуре:
S=Q/T
Если изолированная система получает некоторое количество теплоты при постоянной температуре,то вся теплота идёт на увеличение беспорядочного,хаотичного движения частиц,то есть на увеличение энтропии.Так происходит при плавлении вещества или при его испарении,например при кипении(лёд плавится и вода и кипит при постоянной температуре).Наоборот,порядок увеличивается,например при кристаллизации(замерзании) жидкости,энтропия системы уменьшается и выделяется скрытая теплота плавления.
В газе,где частицы движутся независимо,неупорядоченность гораздо больше,чем в кристалле.Жидкость занимает промежуточное положение.Соответственно,и энтропия вещества в газообразном состоянии больше,чем в жидком,а в жидком больше,чем в твердом.
При обсуждении химических проблем удобно пользоваться определением энтропии,данном Больцманом.
Энтропия ( S ) пропорциональна логарифму термодинамической вероятности ( W ) состояния системы: S = k lnW,
где k — постоянная Больцмана,а термодинамическая вероятность W определяется числом микросостояний,которыми может осуществляться рассматриваемое (макро)состояние.
Вот простой пример соотношения макро- и микросостояния системы.Система-кинозал с 10 рядами по 10 кресел и 100 зрителей.Для наилучшего обзора экрана зрители должны быть рассажены строго по росту с первого по 100 место.Это единственное микросостояние.Если рассадить зрителей по росту в только колонках,то число микросостояний будет равно числу сочетаний из 100 по 10,что составляет 1013
Но если зрители будут рассаживаться произвольно,число микростояний будет равно 100! и это будет самая неупорядоченная система.
В химии же системы такие,что число частиц очень велико.Например,один моль составляет 6·1023
частиц и число микросостояний становится невообразимо большим.
Увеличение энтропии означает возможность самопроизвольного протекания таких процессов,как диффузия газов и жидкостей,любой процесс растворения,осмос.
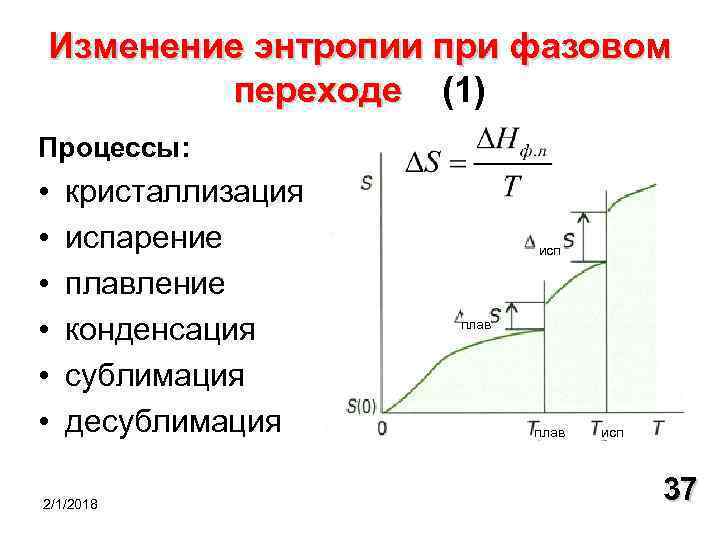
Второе начало термодинамики говорит только о направлении изменения энтропии в процессе,но ничего не говорит об абсолютном значении энтропии.В 19 столетии путем экспериментов были установлены температурные зависимости энтропии для газов и жидкостей при фазовых переходах.При понижении температуры энтропия медленно уменьшается,а при конденсации газа и при кристаллизации жидкости уменьшается резко, скачком.
В 1911 году М.Планк постулировал:
Для идеального кристалла при стремлении температуры к абсолютному нулю,энтропия также стремится к нулю.
Третье начало термодинамики гласит:
Энтропия идеального кристалла при 0 K равна нулю.
Таким образом,значения энтропии отсчитываются от нуля и могут быть найдены для любого состояния вещества и любых условий.
Энтропия измеряется в единицах Дж/K и относится к определённому количеству вещества,обычно к 1 моль.Для веществ в одинаковых состояниях энтропия увеличивается с ростом молярной массы.

Таким образом,появилась ещё одна характеристика химической реакции-изменение энтропии и ещё один критерий-стремление системы к максимуму энтропии.
Итак,ещё раз,энтропия простыми словами-это функция состояния системы (системой может быть простое вещество).
