Водородные связи в биологии
(Здравствуйте уважаемый читатель.Наше настоятельное пожелание-посетите главную страницу сайта.)
Водородную связь относят к числу слабых хим. взаимодействий. Энергия водородной связи как правило лежит в границах от 10 до 30 кДж/моль, но временами она достигает и сотен кДж/моль. Энергии нормальных хим связей (ковалентных и ионных), как правило, сильно превосходят 150 кДж/моль, достигая, к примеру, для молекул азота или же оксида углерода величин 900 кДж/моль и больше [1]. За последние 50 лет было замечено точное осознание исключительной роли слабых взаимодействий, роли водородных связей в стабилизации конденсированных состояний множества несложных молекулярных систем, к примеру воды, фтороводорода, и, что самое значительное, в стабилизации биополимеров (нуклеиновых кислот, белков).
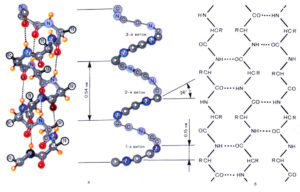
Водородные связи позволяют полимерным цепям соединяться в специфические трехмерные структуры, приобретающие при этом функциональную биологическую активность, структуры, с одной стороны достаточно прочные (за счет образования большого числа водородных связей), а с другой — достаточно чутко реагирующие на изменение внешних условий (например, приближение той или иной молекулы) именно из-за того, что эти взаимодействия являются слабыми.
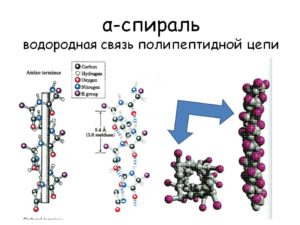
Разрыв таких связей лишает белки или нуклеиновые кислоты их биологических функций. Отсюда, в частности, видна исключительно важная роль водородных связей, которую они играют в биологических процессах на молекулярном уровне. Понятно и то важное значение исследований и понимания природы водородных связей, которым в последние время было уделено столь пристальное внимание ученых различных направлений.
Общей причиной возникновения водородной связи, как, впрочем, и других выделяемых обычно типов химических связей, является главным образом электростатическое, кулоновское взаимодействие разноименных зарядов тех частиц, которые образуют молекулу. Правда, это взаимодействие отличается от того, которое встречается в классической теории, поскольку оно не определяется только лишь плотностью распределения положительного и отрицательного зарядов, а выражается более сложным образом с помощью волновых функций, определяющих состояния молекулярной системы. Поэтому естественно стремление найти некоторые более простые образы, которые давали бы возможность наглядно представить себе, как же все-таки образуется химическая связь.
Водородная связь по своему происхождению не представляет собой нечто отличающееся от того, что характерно для химических связей вообще. Ее определяют главным образом поляризация электронного распределения в мономерных звеньях (в общем случае в молекулах, образующих такую связь) и отличная от мономерных звеньев динамика колебательного движения атомов в водородно-связанном фрагменте. Пристальное внимание к изучению систем с водородными связями давно уже определяется не спецификой этой связи как таковой, а широкой распространенностью водородных связей, особенно в биологических объектах, и той важной ролью, которую они играют в биополимерах и жизненно важных процессах с их участием.
Примеры соединений с водородной связью
Во многих случаях, когда имеется сильная связь между молекулами или разными группами одной и той же молекулы, эту связь можно приписать атомам водорода, проявляющим двухвалентный характер. Таковы, например, димеры алифатических кислот, ион дифторида![]() и димер HF, структура которых приведена на рисунке 1.1.
и димер HF, структура которых приведена на рисунке 1.1.
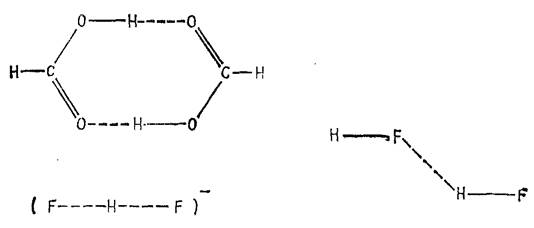
Рисунок 1.1 Некоторые примеры структур с водородной связью
Водород служит в качестве связующего атома в другом важном классе соединений – бороводородах. Простейшим членом этого семейства является диборан (В2 Н6 ). Однако бороводороды обычно не рассматривают в качестве соединений с водородной связью, так как их нельзя разбить на фрагменты, представляющие собой стабильные молекулы. Рассмотрим эти соединения лишь для того, чтобы сопоставить их с комплексами с водородной связью.
Бороводороды были названы электронодефицитнымимолекулами (термин электронодефицитный в применении к бороводородам не совсем оправдан, так как во всех случаях электронов достаточно для заполнения всех связывающих молекулярных орбиталей), так как они не имеют достаточно электронов для образования того количества двухэлектронных связей, которое, по-видимому, подразумевается их молекулярной геометрией. Диборан имеет восемь связей В–Н, но только четырнадцать валентных электронов. Расчеты на основе метода молекулярных орбиталей показывают, что концевые связи представляют собой нормальные двухэлектронные связи, а мостиковые связи следует описывать как трехцентровые двухэлектронные связи.
Описание на основе метода молекулярных орбиталей иона дифторида полностью отличается от описания диборана, поскольку для образования мостиковых связей здесь имеются четыре электрона. Равновесная конфигурация молекулы линейная, причем водород находится посредине отрезка F–F. Две наивысшие заполненные молекулярные орбитали образованы в основном 2p σ -орбиталями фтора п ls -орбиталями водорода с некоторой добавкой 2s -орбиталей фтора. Низшая из двух орбиталей имеет симметрию σ g и является связывающей для всех трех атомов. Более высокая орбиталь σ u (ее узел приходится на атом водорода) – разрыхляющая по отношению к атомам фтора. Однако атомы фтора достаточно удалены друг от друга, так что разрыхляющий эффект мал, и орбиталь σ u имеет отрицательную энергию (т. е. связывает электроны), что обусловлено большой электроотрицательностью атома фтора.
Можно преобразовать σ g — и σ u -орбитали в эквивалентные орбитали θ1 = σ g + σ u и θ2 = σ g – σ u , локализованные на двух связях F–Н, что демонстрирует отличие от мостиков в бороводородах, орбитали которых не могут быть локализованы на связях.
Ион дифторида не типичен для соединений с водородными связями в том отношении, что атом водорода расположен посредине между двумя тяжелыми атомами. Обычно энергии водородных связей намного меньше, чем для иона дифторида, а водород более тесно связан с одним из атомов, чем с другим, как в димере муравьиной кислоты (рис. 1.1). В действительности геометрия двух компонентов, составляющих комплекс, немного отличается от их геометрии в изолированных состояниях.
Таблица 1.1 Энергии димеризации некоторых газофазных димеров с водородной связью
| Димер | Энергия димеризации, кДж/моль-1 |
| (HF)2 | 29±4 |
| (H2 O)2 | 22±6 |
| (NH3 )2 | 19±2 |
| (HCl)2 | 9±1 |
| (H2 S)2 | 7±1 |
Димер HF
Геометрическая конфигурация, колебания, энергия связи
На рисунке 1.2 изображена равновесная геометрическая конфигурация комплекса, одновременно и понятная и непредсказуемая. Все четыре атома располагаются в одной плоскости. Расстояния между атомами фтора и водорода, относящиеся к составным (мономерным) частям комплекса Fb –Hb и Ff –Hf , равны соответственно 0,922 и 0,920 Å и мало отличаются от равновесного расстояния 0,917 Å в молекуле HF. Расстояние между атомами Hb …Ff равно 1,82 Å, что характерно для водородной связи. Расположение всех трех участников водородной связи Fb –Hb …Ff близко к линейному. Это все предсказуемые черты межмолекулярного комплекса с водородной связью. Непредсказуемыми из простых принципов оказываются значения углов θ1 = 7 ̊ (между направлениями Fb Ff и Ff Hb) и θ2 = 69 ̊ (Fb Ff и Ff Hf ).
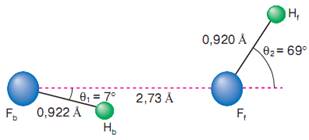
Рисунок 1.2 Равновесная геометрическая конфигурация комплекса (HF)2