Ковалентная химическая связь образуется за счет
(Здравствуйте уважаемый читатель.Наше настоятельное пожелание-посетите главную страницу сайта.)
-
ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами;
-
ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака взаимодействующих атомов.
- Согласно методу валентных связей, связь между атомами А и В образуется с помощью общей пары электронов.
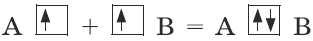 Ковалентная связь.
Ковалентная связь.
Метод ВС прост, нагляден и позволяет предсказать свойства многих молекул, таких как пространственная конфигурация, полярность, энергия, длина связи и др.

Но метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул: парамагнетизм молекулы О2; большую прочность связей в молекулярных ионах F+2 и O+2 по сравнению с молекулами F2 и O2; мéньшую прочность связи в ионе N+2 , чем в молекуле N2; существование молекулярного иона Не+2 и неустойчивость молекулы Не2 и т.д.
Более плодотворным оказался другой подход к объяснению ковалентной связи – метод молекулярных орбиталей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей.
Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствующую образованию химической Ковалентная химическая связь образуется за счет связи и называется связывающей.
Молекулярной орбитали, образовавшейся от вычитания атомных орбиталей соответствует более высокая энергия, чем атомной орбитали. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими.
Электроны, занимающие связывающие и разрыхляющие орбитали, называются соответственно связывающими (св) и разрыхляющими (разр).
Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Гунда.
Подобно электронным формулам, показывающим распределение электронов в атоме по атомным орбиталям, в методе МО составляют формулы молекул, отражающие их электронную конфигурацию. По аналогии с атомными s-, p-, d – орбиталями молекулярные орбитали обозначаются греческим буквами σ, π, δ, φ.
По возрастанию энергии МО орбитали двухатомных молекул первого периода и начала второго периода (до N2) можно расположить в следующем порядке:
σ св 1s < σразр 1s < σсв 2s < σразр 2s < πcв 2py = πcв 2pz < σсв2px < πразр 2py = πразр 2pz < σразр 2px
Молекулярные орбитали двухатомных молекул конца второго периода по возрастанию энергии располагаются в несколько иной ряд:
σ св 1s < σразр 1s < σсв 2s < σразр 2s < σ св 2px <πcв 2py = πcв 2pz < πразр2py = πразр 2pz < σразр 2px
Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих электронов, деленной на два. Порядок связи может быть равен нулю, когда молекула не существует, целому или дробному положительному числу.