В чём сущность образования ковалентных связей.
(Здравствуйте уважаемый читатель.Наше настоятельное пожелание-посетите главную страницу сайта.)
Сначала определим, откуда возникает энергия химической связи в общих случаях.С точки зрения строения атомов,попробуем понять что такое химическая связь на простейшем примере-молекулярного иона водорода H2+,содержащего два протона и один электрон.Сами по себе эти ионы устойчивы(хотя не существуют в присутствии других веществ).Чтобы разделить их на H и H+,нужно затратить 265 кДж/моль-столько энергии содержится в этой химической связи.
Чтобы понять в чём сущность образования ковалентных связей,
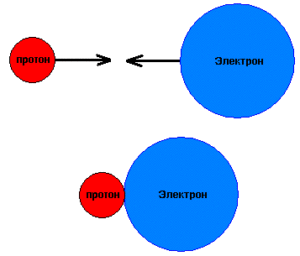
сначала надо рассмотреть классическую картину кулоновских взаимодействий между двумя протонами и одним электроном в нашем случае.
Между ядрами действуют силы отталкивания,а между ядром и электроном-силы притяжения.В зависимости от положения электрона по отношению к линии,соединяющей ядра,возникает или отталкивание ядер,или связывание,притяжение.И все пространство вблизи ядер разделяется на области связывания и разрыхления.Силы же,действующие на электрон,направлены в область связывания,что и способствует образованию связи.
Теперь рассмотрим простейшую молекулу H2.
Из этих молекул состоит водород-газ,устойчивый в обычных условиях.Так как в области связывания делокализованы уже два электрона,энергия связи возрастает до 436 кДж/моль,почти вдвое,т.к. появилось межэлектронное отталкивание.