Откуда вообще возникает энергия химической связи?Рассмотрим на примере молекулярного иона водорода H2 + ,содержащего два протона и один электрон.Сами по себе такие ионы устойчивы,но в присутствии других веществ не существуют,так как отрывают от них ещё один электрон. Чтобы разделить молекулярный ион водорода на H+ и H ,нужно потратить энергию,равную энергии химической этой связи 265 кДж/моль.
Откуда она берётся?Надо рассмотреть кулоновские взаимодействия,возникающие между двумя протонами и одним электроном ,составляющим эту систему.
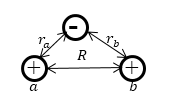
Между ядрами (протонами) действуют силы отталкивания,а меду каждым ядром и электроном — силы притяжения и всё пространство вблизи ядер можно разделить на области связывания и отталкивания.В зависимости от положения электрона возникает результирующая сила или связывания ядер,либо отталкивания.Равнодействующая же сила,действующая на электрон,направлена в область связывания.что и способствует образованию связи.
Итак,причина образования химической связи — одновременное взаимодействие электрона с двумя ядрами (или в общем случае с несколькими).Единственный электрон в молекулярном ионе водорода в равной степени взаимодействует с обоими протонами,он делокализован симметрично между ними,причем большая часть его плотности сосредоточена в области связывания.
Добавим к системе ещё один электрон и рассмотрим молекулу водорода H2 .Так как в области связывания теперь делокализованы два электрона,энергия связи возрастает с 265 до 436 к
дж/моль.Она бы увеличилась ровно в два раза,если бы не появилась сила межэлектронного отталкивания.

Делокализация электронов является необходимым условием и главной причиной образования химической связи — делокализованный отрицательный заряд электронов,находящихся в области связывания между ядрами,связывает положительно заряженные ядра друг с другом.Образованная таким образом связь носит название ковалентной химической связи.
Ионная,или элекростатическая связь имеет электростатическую природу.Образуется в случае полного переноса связывающих электронов к более электро отрицательному атому,который становится в результате этого отрицательным ионом — анионом с зарядом,равным количеству перенесённых электронов.Менее электроотрицательный атом теряет соответствующее количество электронов и становится положительным ионом — катионом.В принципе,это предельный случай полярной ковалентной связи.Это реализовывается лишь при взаимодействии атомов,сильно отличающихся по электроотрицательности,например в LiF,NaCl,BaO.Но доже в таких соединениях электроны не полностью переходят с катионов на анионы,а часть электронной плотности остаётся делокализованной между ними.Такая связь может считаться преимущественно ионной с небольшой долей ковалентности. В силу электростатической природы ионная связь не имеет определённого направления в пространстве и ионные соединения не состоят из отдельных молекул,а образуют трёхмерные кристаллические структуры,в которых взаимное расположение анионов и катионов определяется соотношением их радиусов,а количество их зарядами.Энергия ионной связи рассчитывается по закону Кулона,в соответствии с зарядами,радиусами ионов и типом кристаллической решётки.