Так как молекулы воды полярны,в ней ,как и в любой другой жидкости,происходит самоионизация:
H₂ O+H ₂ O↔H3O++OH¯
H2O↔H++OH¯ или по другому так:
2 H2O(ж) ⟶ H3O+ (p-p) + OH¯ (p-p)
индекс «p-p» означает,что протон удерживает около себя несколько молекул воды,образуя ионы H3O+ , H5O2 + и так далее.Обычно все виды взаимодействий ионов воды записывают в краткой форме:
H2O ⟶ H++OH¯
Этому равновесию отвечает константа:
K = [ H+ ][ OH¯ ]/[ H2O ]
[ H+ ] = [ OH¯ ] = Kw ⁻ ½ =1.0 ∙10⁻⁷ при 22 °C .
Для удобства выражения кислотности или щелочности растворов был введён водородный показатель.
Водородный показатель — десятичный логарифм концентрации водородных ионов (в моль/л),взятый со знаком минус, — lg [ H+ ] =pH (произносится «пэ аш»).В нейтральной среде pH равен семи,в кислой-меньше семи,в щелочной-больше семи.

Измерение pH широко используется в совершенно разных областях.В медицине и биологии pH крови и других физиологических растворов характеризует процессы жизнедеятельности животных и растений.Так как кислотность биологических жидкостей лежит в узких пределах,отклонение от которых свидетельствует о патологических процессах,то величина pH служит для определения патологий.Например,кровь имеет pH 7.35-7.45. слёзы — 7,4,а желудочный сок очень кислый (pH — 0.9).Для природных вод pH является важнейшим экологическим,гидрохимическим показателем.
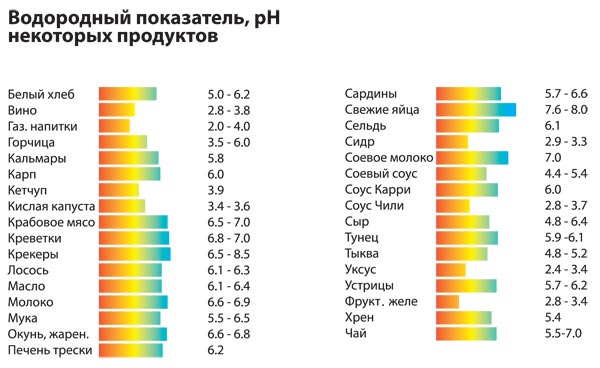
Величина pH используется для контроля в пищевой,химической,бумажной,текстильной,нефтяной и практически в любой отрасли промышленности,имеющей дело с растворами.