Какой газ называют идеальным.
Газ-это такое состояние вещества,в котором вещество не имеет ни собственного определенного объёма,ни определённой формы.
Обычными свойствами любого газа являются стремление занять возможно больший объём и сильная зависимость объёма от температуры и давления.
В результате экспериментов установлено:объём газа зависит от давления-P,температуры-T,и числа молекул-N.Выведены законы,устанавливающие зависимость объёма от каждого из трех параметров при постоянстве двух других.
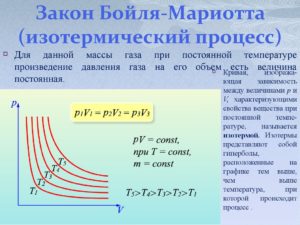
1.Закон Бойля-Мариотта: при постоянной температуре объём данной массы газа обратно пропорционален давлению:
V=const/P или PV=const (T,N = const)

Закон Гей-Люссака-Шарля: при постоянном давлении объём данной массы газа обратно пропорционален абсолютной температуре:
V=const∙T или V/T=const (P,N = const)


3.Закон Авогадро:при постоянных температуре и давлении в равных объёмах газов содержится одинаковое число молекул:
V=const∙N или V/N=const (P,T = const)


Закон Авогадро имеет важное следствие: при одинаковых условиях молярные объёмы всех газов одинаковы.Если принять N=NA ,то количество любого газа равно 1 моль.Обычно объемы газов относят к нормальным условиям:P=101325 Па (101 кПа),T=0°C.При нормальных условиях молярный объём газа V0 =22,4л.
С возрастанием точности измерений и расширением диапазона измеряемых параметров-температуры и давления,становилось понятней,что газовые законы имеют приближенный характер.
При разработке молекулярно-кинетической теории газов для понимания общих законов ученые придумали гипотетический газ,который строго подчиняется газовым законам при любых давлениях и температурах.Этот газ называется идеальным газом.Для 1 моль идеального газа PV/T=const=R.
Постоянная R называется универсальной газовой постоянной.Числовое значение R получается измерением объёма 1 моль газа при нормальных условиях: T=0°C=273 K и P=101,3 кПа=1,013∙10⁵ Па.При таких условиях Vₒ=22,4 л.

Тогда R=(1,013∙10⁵ Па ∙ 22,4 л)/(273 K ∙ 1 моль)=8.331 ∙ 10³ л ✕ Па/(K ∙ моль)=8.31 ∙ кПа/(K ∙ моль).
Для n молей идеального газа действительно равенство PV/T = nR или PV = nRT.
Так как n = m/M,где m — масса газа,а М — его молекулярная масса,то
PV = (m/M)RT
Это уравнение называется уравнением Менделеева-Клайперона.Оно связывает все параметры,влияющие на состояние газа.В большинстве случаев принимается,что в газообразном состоянии все вещества ведут себя как идеальный газ при давлениях,близких к атмосферному (101,кПа) и ниже.



